لایهی SEI (قسمت دوم)
در قسمت اول معرفی SEI در مورد کلیات لایهی SEI بحث شد و به بررسی محدودهی پایداری الکترولیت پرداختیم و دیدیم که کاتدهای رایج مشکل تشکیل SEI را نداشته ولی آندهای گرافیتی و سیلیکنی به دلیل ولتاژ پایین، دارای این لایه میباشند. در این مقاله به جزئیات بیشتری مانند نحوهی شکلگیری و بهبود خواص این لایه میپردازیم.
بهبود خواص لایه SEI
ترکیبات افزودنی الکترولیت
برای حصول پایداری و یکنواختی در خروجی باتری و همچنین برای محافظت الکترودها و عوامل دیگر، علاوه بر نمک لیتیوم، مواد دیگری نیز به الکترولیت اضافه میشود. از این مواد تحت عنوان افزودنیها (Additive) یاد میشود. البته این مواد کمتر از 5 درصد از کل محلول الکترولیت را تشکیل میدهند اما همین مقدار کم نقش حیاتی در عملکرد باتری داشته و عدم وجود آنها موجب از کار افتادن سریع باتری میشود. الکترولیت مایع معمولا محلول استاندارد لیتیوم هگزافلوئوروفسفات (LiPF6) در مخلوطی از آلکیل کربناتها (Alkyl Carbonates) مثل اتیلن کربنات، دی اتیل کربنات و … میباشد.
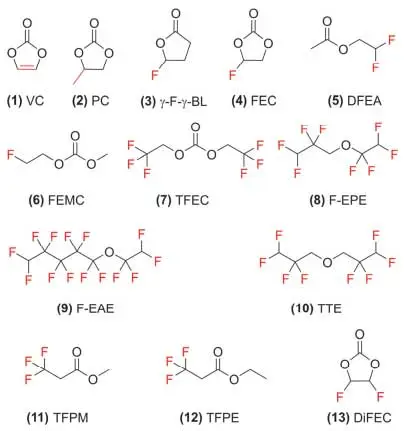
در باتریهای لیتیوم یون با الکترولیت مایع، لایه SEI در سطح مشترک الکترولیت و الکترود تشکیل می شود. در واقع بعد از ساخت باتری این لایه الکترولیتی جامد به طور خود بخود بر سطح الکترود تشکیل می شود. تشکیل یک لایهی پایدار و مقاوم از اهمیت بالایی برخوردار است و تشکیل SEI با ساختاری نارسانا و ناپایدار می تواند کارآیی باتری را تضعیف نماید. همچنین با مصرف برگشت ناپذیر یون های الکترولیت، طول عمر باتری را کاهش داده و باتری را غیرقابل شارژ می کند.
” بیشتر بخوانید: عملکرد کلی باتری های لیتیوم یون “
استفاده از افزودنی ها، برگشت ناپذیری باتری را کاهش داده، از تشکیل گاز در مسیر تشکیل SEI ممانعت نموده و باعث طولانیتر شدن عمر باتری شوند. این مواد به طور موثری باعث تشکیل SEI با ساختارهای بهبود یافته میشوند که تاثیرات مخرب کمتری بر عملکرد کل باتری می گذارد.
مکانیزم تشکیل SEI
تحقیقات وسیع و گستردهای که با استفاده از روش های طیف سنجی مختلف صورت گرفته مشخص نموده است که SEI از تجزیه حلالها و نمکهای الکترولیت تولید میگردد. این اجزا شامل Li2CO3، لیتیوم آلکیل کربنات، لیتیوم آلکوکسید، بخشهای نمکی دیگر مثل LiF برای الکترولیتهای با پایه LiPF6 میباشند.
شکل زیر دو مکانیزم کاهش حلالهای با پایهی کربنات را میتوان مشاهده کرد که در اینجا RA نشان دهنده رادیکال آنیون(Radical Anion) است. هر دو مکانسیم در فرایند تشکیل SEI حضور داشته و در رقابت با یکدیگر میباشند.
” بیشتر بخوانید: لایهی محافظتی ارتقاء یافته در باتری بر پایهی فلز روی “
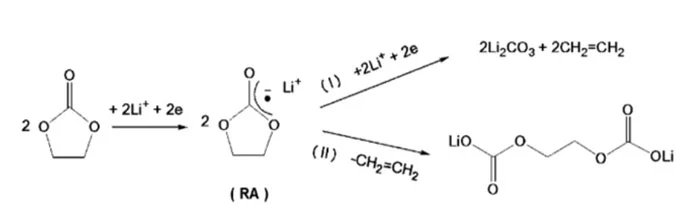
وقتی که فرایند یک بیشتر اتفاق افتد کاهش حلال آلی محصولات گازی بیشتری را تولید نموده (گاز اتیلن)، SEI تشکیل شده شامل مقادیر فراوان Li2CO3 بوده و ناپایدار میباشد. برعکس در مکانسیم دوم محصولات گازی کمتری ایجاد شده و تولیدات حاصل به طور مناسبی در الکترولیت نامحلول میباشند و در نتیجه تشکیل SEI پایدار و متراکم مینمایند. بنابراین در باتریهای لیتیوم-یون مطلوب این است که مکانسیم دوم بیشتر رخ دهد زیرا تولید گاز در مکانسیم اول باعث کاهش پایداری و یکنواختی SEI میشود.
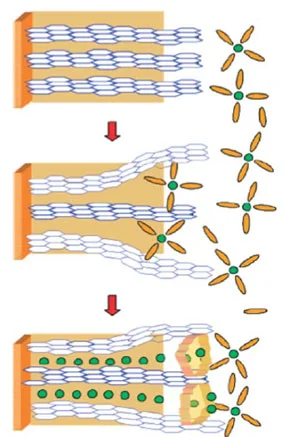
این نوع از افزودنی ها در فرایند تشکیل SEI دخالت نموده و این فرایند را با مکانیسم دوم شرح داده شده در بالا پیش می برند. تحقیقات زیادی بر روی عوامل موثر بر این دو مکانسیم انجام شده است به عنوان مثال،گرافیت و فعالیت کاتالیزوری آن، بر مسیر مکانسیم تشکیل SEI بسیار موثر هست.
اثر کاتالیستی گرافیت به شدت به موقعیت گرافیت وابسته است و جنس SEI تشکیل شده را تغییر میدهد به طوری که SEI تشکیل شده در لبههای (edges)یک گرافیت پیرولیتی (Pyrolitic Graphite)، غنی از مواد معدنی است در حالی که SEI در قائده های صفحهای (Basal Plane)، غنی از مواد آلی می باشد.
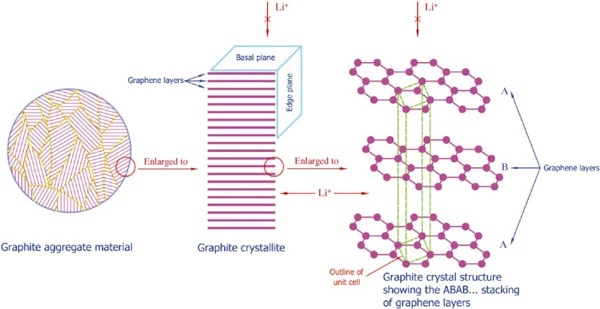
اصلاح سطح گرافیت با روش های مختلف فیزیکی و شیمیایی باعث بهبود پدیده کاتالیستی میشود. به عنوان مثال اکسیداسیون ملایم و پوشش فیزیکی بعضی مواد بر روی سطح گرافیت به طور موثری تشکیل SEI را تسهیل نموده و تولید گاز را در مراحل اولیه قرارگیری لیتیوم در بین لایه های گرافیت کاهش می دهد.
منبع: edu.nano.ir